pHはなぜ測定するの?
そもそもpHって何?
pHは「ピーエッチ」または「ペーハー」と読み、日本語では「水素イオン指数」と訳します。
pHは、その液体が酸性なのか、アルカリ性なのかを表す尺度です。

数値は普通1から14までの値となり、7が真ん中で「中性」といいます。
pHが7より小さいと「酸性」、7より大きいと「アルカリ性」となります。
pHを測ることで、その液体に何が溶けているのかある程度推測できたりします。

pHの読み方

第二次世界大戦の前後の日本では科学の情報の多くがドイツから入ったため、pHは「ペーハー」とドイツ語由来で読まれていました。
歴史的背景から、今でも年配者の方に多い読み方です。
一方現在の日本では計量単位規則により「ピーエッチ」と読むことが義務付けられています。
学校でも「ピーエッチ」と指導しなければならないのですが、昔の名残りから、先生の中でも「ペーハー」と読んで指導してしまう方もいるようです。
pHの単位とpHを示す数字の意味
pHは水素イオン濃度指数を表し、その液体に水素イオン「H+」がどのくらい存在しているかを表すための単位です。
液体の酸性、アルカリ性は、その液体に溶けている水素イオンの量によって決まります。
完璧に純粋な水1Lの中には、1atm(大気圧)・25℃のとき水素イオンが10000000分の1「モル」存在しています。
この水素イオンは、純粋な水 = H2Oが次の式のようにイオンに分かれた結果発生します。
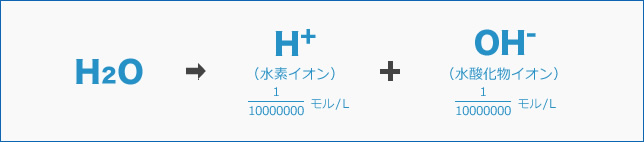
純粋な水の中には水素イオンと水酸化物イオンが同じ量存在しており、「酸性」でも「アルカリ性」でもないため、「中性」となるのです。
![]()
純粋な水の水素イオンの濃度は10000000分の1モル/ Lとなります。 このように表現すると数字が非常に多くなって読みにくいので、分母の10000000を107(10を7回掛け算するという意味)と書き換えて
![]()
この10の右肩にある7を使ってpH7と表現します。
pH7を「中性」と言い、 pHが7より小さい場合、水素イオン濃度は中性のときよりも多くなり、「酸性」となり、
pHが7より大きい場合、水素イオン濃度は中性のときよりも少なくなり、「アルカリ性」となります。
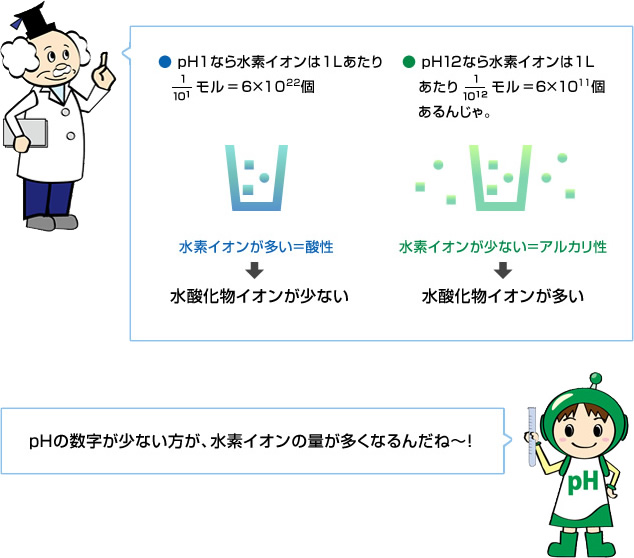
| pH1なら | pH12なら | |
|---|---|---|
| モルでの濃度 |  | |
| 個数での濃度 |
pHと残留塩素の関係
消毒効果が高い「遊離残留塩素」の中にも、さらに2つの遊離残留塩素が存在します。次亜塩素酸と次亜塩素酸イオンです。
pHによる塩素系薬剤の消毒効果は、殺菌力の強い次亜塩素酸(HClO)と、殺菌力がその1/100程度に過ぎない次亜塩素酸イオン(OCl–)の比率により異なります。
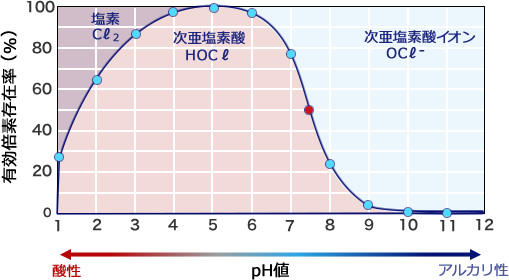
図に示すように、pHが7.5を越えたあたりから次亜塩素酸イオンが優位になっています。
ココで重要になるのは、もしDPD試薬№1で残留塩素濃度を測定して値が0.5mg/Lだったとしても、pHを一緒に測定しないと真の消毒効果がわからないということです。
pHが6や7であれば、遊離残留塩素は消毒効果が高い次亜塩素酸の形態なので安心ですが、pHが10だとしたらほぼ次亜塩素酸イオンであり、消毒効果が若干心配になっています。
